Chemie 9. Klasse
Falls Ihr etwas wiederholen / wieder anschauen müsst: Weiter unten auf dieser Seite findet ihr die Inhalte der 8. Klasse.
Unedle und edle Metalle: die Sauerstoffaffinität
Dazu haben wir die Heftigkeit und Energiefreisetzung (Lichtfarbe) bei der Reaktion von Magnesium, Zink, Kupfer und Eisen mit Sauerstoff betrachtet. Außerdem kann man beobachten wenn man Magnesium brennend in Kohlenstoffdioxid hält, dass das Magnesium in dem erstickend wirkenden Gas erstaunlicherweise weiter brennt. Magnesium hat eine so große Sauerstoffaffinität, das es dem Kohlenstoff im Kohlenstoffdioxid den gebundenen Sauerstoff wegnehmen kann. Magnesium und Kohlenstoffdioxid reagiert daher zu Kohlenstoff und Magnesiumoxid. Die Oxidation von Magnesium funktioniert sogar mit Trockeneis (festen Kohlenstoffdioxid) - siehe Film.
Herstellung von Metallen aus Metalloxiden durch REDUKTION
METALLHERSTELLUNG
Wie kann man Metalle aus Metalloxiden (Metallerzen) herstellen?
Hierzu wird die Verbrennung der unedlen Metalle umgekehrt. Man muss dem Metall der Metallverbindung den Sauerstoff "wegnehmen". Deshalb wird eine Reaktion mit einem Reaktionspartner durchgeführt der eine größere Sauerstoffaffinität als das Metall der Metallverbindung hat. Dies kann bei Kupfer und Eisen u.a. Magnesium, Aluminium, Wasserstoff und Kohlenstoff sein. Kohlenstoff und Wasserstoff haben den verfahrenstechnischen Vorteil, dass ihre Oxide gasförmige Stoffe sind und deshalb bei der Reaktion entweichen. Eine aufwendige Stofftrennung der Produkte entfällt dadurch.
Wir haben folgende Reaktionen im Unterricht behandelt:
- Kupfergewinnung aus Kupferoxid + Kohlenstoff
- Eisen aus Eisenoxid + Aluminium (Thermitreaktion / Aluminothermisches Verfahren). Sieh dir doch den Youtube-Film hierzu an!
- Eisen aus Eisenoxid + Kohlenstoff (Hochofenprozess und Stahlherstellung, s. BUCH!!). Hier der Link zum Film über die Eisen- und Stahlherstellung früher und heute.
Legierungen
Bei einer Legierung handelt es sich im Regelfall um ein homogenes Gemisch aus mindestens einem Metall und eins, zwei ... weiteren Elementen. Stahl ist z.B. eine Legierung aus Eisen und Kohlenstoff. Spezialstähle enthalten neben dem Eisen auch andere Elemente, wie z.B. Vanadium, Nickel und Molybdän bei Edelstahl, Werkzeugstahl u.a.
Die Menschheit hat schon sehr früh Legierungen verwendet, da ihre Werkstoff-Eigenschaften besser als die der reinen Metalle waren. Beispiele sind Bronze, eine homogene Mischung aus Kupfer und Zinn (--> Bronzezeit) und Messing, eine homogene Mischung aus Kupfer und Zink.
Aufbau der Materie: Atombau
Erste Ideen zum Aufbau der Materie stammen von den alten Griechen (Postulierung von Atomen als kleinste Teilchen aller Stoffe) und dann von John DALTON:
- Materie besteht aus Atomen, kleinen und unteilbaren Teilchen.
- Die verschiedenen chemischen Grundbausteine (= Elemente) bestehen jeweils aus einer für sie typischen Atomsorte, d.h. Eisen aus Eisenatomen, Gold aus Goldatomen ....
- Eisen- und Goldatome haben jeweils ein unterschiedliches, für dieses Element typisches Gewicht und Größe.
- Andere Stoffe entstehen durch chemische Reaktionen, bei denen sich Atome der Grundbausteine (Elemente) zu Verbindungen (Atomgruppen) zusammenfügen.
Nach dem Rutherford´schen Atommodell bestehen Atome aus einem Atomkern und einer Atomhülle. Der Atomkern enthält die positiv geladenen Protonen und die ungeladenen Neutronen, während die Atomhülle nur die fast masselosen, negativ geladenen Elektronen enthält.
- Atombau nach Rutherford im Film (musstewissen-Reihe)
- Rutherford'sches Atommodell in der Selbstlern-Animation
Atombau interaktiv:
Das Ergebnis des Rutherford´schen Streuexperimentes
Elementarteilchen (Atombauteile, also Elektronen, Protonen und Neutronen) und ihre Eigenschaften
Aufbau der Elektronenhülle
Nach dem Atommodell von Niels Bohr existieren in der Atomhülle einzelne Energieniveaus für Elektronen, die wir uns wie Schalen vorstellen können. Der Kern ist von maximal sieben unterschiedlich großen Elektronen-enthaltenden Schalen umgeben, welche zusammen die Atomhülle bilden. Die negativ geladenen Elektronen unterschiedlicher Schalen besitzen unterschiedliche Energie, da sie dem Anziehungsfeld des positiv geladenen Atomkerns verschieden stark ausgesetzt sind. Die Elektronen werden von der Natur nach bestimmten Regeln auf die unterschiedlichen Schalen verteilt.
Übe den richtigen Aufbau der verschiedenen Atome mit der Phet-Animation. Die Anleitung zur Animation findest Du hier: Anleitung "Bau ein Atom" Da kannst Dein Wissen auch spielerisch testen --> Klicke dazu auf Spiel ganz unten in der Mitte rechts.
Film zum Periodensystem und Atombau (musstewissen-Reihe) und Teil 2
Hier gibt es ein PERIODENSYSTEM DER ELEMENTE zum ausdrucken.
Merksprüche für das Periodensystem der Elemente (Periode = Zeile):
2. Periode: Liebe Berta, Bitte Comm Nicht Ohne Frische Nektarinen.
3. Periode: Natascha M(a)g Alois. Sie Putzt Seine Clobigen Arbeitsschuhe.
4. Periode: Kann Carl Ganze Geschichten A(u)s Seiner Bratsche Kratzen?
Ein Spruch aus eurer Klasse: Karsten Caute (kaute) Ganz Genüsslich (und) Aß (As) Seine Braune Kröte
Eigenschaften und chemische Reaktionen der 1. Hauptgruppe (Alkalimetalle)
Die Elemente der 1. Hauptgruppe (Alkalimetalle) Lithium, Natrium, Kalium, Rubidium, Cäsium und Francium (radioaktiv) sind Metalle. Sie leiten elektrischen Strom, zeigen an frischen Schnittkanten den typischen metallischen Glanz und sind gute Wärmleiter. Die bekanntesten Alkalimetalle Lithium, Natrium, und Kalium haben einen niedrigen Schmelzpunkt, eine geringere Dichte als Wasser (diese Alkalimetalle schwimmen auf Wasser!) und lassen sich mit einem Messer schneiden. Sie haben ähnliches chemisches Reaktionsverhalten. Zum Beispiel reagieren sie alle sehr leicht mit dem Sauerstoff der Luft (Schnittflächen laufen durch Oxidbildung sofort an) und mit Wasser. Bei dieser von Li bis Cs immer heftigeren, stark exothermen Reaktion entsteht jeweils Wasserstoff und eine Lauge.
Filme:
Reaktion der Alkalimetalle Li bis Cs mit Wasser (Sodium = englische
Bezeichnung für Natrium, Potassium = Kalium)
Reaktionsverhalten der Alkalimetalle Li bis Cs mit Wasser (spektakuläres BRAINIAC Video)
Eigenschaften und chemische Reaktionen der 7. Hauptgruppe (Halogene)
Durch Reaktion von Kaliumpermanganat und Salzsäure kann man gelbgrünes Chlorgas erzeugen und seine Eigenschaften, z.B. die bleichende Wirkung auf das Chlorophyll eines grünen Laubblattes kennen lernen. Die Halogene haben als Nichtmetalle relativ niedrige Schmelz- und Siedepunkte, sind farbig, bestehen aus zweiatomigen Teilchen ("Zwillingsteilchen") und sind sehr reaktiv. Fluor und Chlor sind bei Raumtemperatur und Normaldruck gasförmig, Brom ist flüssig und Iod ein Feststoff. Alle Halogene sind im gasförmigen Zustand schwerer als Luft.
Übersicht über die Eigenschaften der Halogene
Herstellung von Chlor
Herstellung von Natriumchlorid, einer Ionenverbindung (ein Salz) aus Natrium und Chlor
Ionen entstehen durch Elektronenübergang, z.B. zwischen einem Alkalimetall (I. Hauptgruppe) und einem Halogen (VII. Hauptgruppe). Das Alkalimetall, z.B. Natrium muss sein einziges Außenelektron los werden, damit es die besonders stabile Edelgaskonfiguration erreicht. Das Halogen, z.B. ein Chloratom, braucht noch ein Elektron, damit es acht Außenelektronen hat. Durch Elektronenübergang von Natrium zum Chlor entsteht die Ionenverbindung NaCl, ein Salz, das aus Na+ - und Cl- -Ionen besteht. Die Ionenentstehung haben wir im Experiment bei der Reaktion von Natrium und Chlor zum Natriumchlorid gesehen - siehe Video ! Im Produkt NaCl haben durch den Elektronenübergang sowohl die Natriumionen, als auch die Chloridionen die sehr stabile Edelgaskonfiguration errreicht. Die folgende Filmleiste zeigt den Vorgang des Elektronenübergangs im Detail:
Eigenschaften von Ionenverbindungen (Salze)
- Ionenverbindungen bilden als Feststoffe Ionengitter, denn entgegengesetzt geladene Ionen ziehen sich an.
- Sie sind hart und spröde.
- Sie haben außerdem einen hohen Schmelz- und Siedepunkt und lösen sich meist gut in Wasser.
- Als Feststoff sind sie elektrische Nichtleiter.
- Gelöst in Wasser oder geschmolzen leiten Salze / Ionenverbindungen elektrischen Strom gut.
- Wird elektrischer Gleichstrom durch eine Salzlösung geleitet, so wandern die gelösten, frei beweglichen Ionen.
- Außerdem zersetzt sich die Salzlösung. An den Elektroden entstehen aus den positiv oder negativ geladenen Ionen ungeladene Atome oder Moleküle. Den Vorgang der Zersetzung einer Verbindung durch Strom nennt man ELEKTROLYSE.
Die folgende Animation zeigt die Elektrolyse der Ionenverbindung (Salz) Kupferchlorid auf der Teilchenebene.
Ionenverbindungen - Entstehung und Eigenschaften: siehe Buch S. 208 - 211!
Die Eigenschaften von Salzen erklärt auch dieses Video:
Zusammenfassung zu Ionenverbindungen / Salzen mit Ionenbindungen
Moleküle: Teilchen, in denen Atome durch Elektronenpaarbindungen / Atombindungen verbunden sind
Achtung: Aus technischen Gründen können hier auf dieser Seite bei Formeln im Text die Zahlen leider nicht korrekt, also klein als Index, geschrieben werden. Die Formel für Wasser wird daher zu H2O statt

Traubenzucker und reines Wasser leiten den elektrischen Strom nicht. Auch eine Zuckerlösung, also in Wasser gelöster Zucker, leitet den elektrischen Strom nicht und unterscheidet sich daher deutlich von Ionenverbindungen / Salzen. Zucker und Wasser bestehen offenbar nicht aus Ionen. Was hält dann die 24 Atome im Zucker- und die drei Atome im Wasserteilchen zusammen?
Es sind so genannte Elektronenpaarbindungen. Bei ihrer Bildung steuern beide Bindungspartner jeweils ein zuvor ungepaartes Elektron zu einem gemeinsamen bindenden Elektronenpaar bei.
Die durch Elektronenpaarbindungen (auch Atombindungen genannt) zusammen gehaltenen Teilchen einer Verbindung nennt man Moleküle. Durch die Bildung der gemeinsamen Elektronenpaare erreichen beide Bindungspartner die energetisch vorteilhafte Edelgaskonfiguration ihrer Elektronenhülle.
Man kann mit der Lewisschreibweise und wenigen Regeln mittels Atomsymbolen und Streichhölzern Moleküle "basteln". So geht´s:
Elektronenpaare mit ihren zwei Elektronen werden durch Streichhölzer dargestellt. Ein halbes Streichholz entspräche einem Elektron.
Regel 1: Alle Atome müssen eigene Valenzelektronen entsprechend ihrer Stellung im Periodensystem haben. 1. Hauptgruppe = 1 Außenelektron, 2. Hauptgruppe 2 Außenelektronen ....
Regel 2: Alle Atome im Molekül erreichen die Edelgaskonfiguration (Oktettregel), d.h. sie kommem mit ihren eigenen und den Bindungselektronen auf 8 oder wie Helium auf 2 Außenelektronen in der äußersten bzw. ersten Elektronenschale. Hierbei werden die beiden Elektronen von Elektronenpaarbindungen jeweils bei beiden Bindungspartnern mitgezählt.
Regel 3: Die Gesamtzahl der Elektronen im Molekül entspricht der Summe der Elektronen aller Atome des Moleküls.
Dies bedeutet z.B. beim Wassermolekül H2O, dass insgesamt maximal 6 (vom O) + 2x 1 (von den zwei H) = 8 Außenelektronen zur Verfügung stehen.
Lewisschreibweise und Valenzstrichformeln
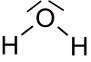
Und wie man sieht, werden in der Strukturformel tatsächlich insgesamt vier Striche verwendet. Da jeder Strich gleichbedeutend mit 2 Elektronen ist, kommt man auf insgesamt 8 Außenelektronen im Wassermolekül. Alle Atome erreichen Edelgaskonfiguration. Sauerstoff hat insgesamt 8 Außenelektronen zur Verfügung (6 eigene plus zwei zusätzliche aus den zwei Bindungen zum Wasserstoff), Wasserstoff hat insgesamt zwei Außenelektronen auf der innersten Schale zur Verfügung und erreicht damit die Edelgaskonfiguration vom Heliumatom (je ein eigenes und eins aus der Bindung zum Sauerstoff).

Elektronegativität und die
ungewöhnlichen Eigenschaften von Wasser
Zwischen Atomen mit gleichartiger Elektronegativität sind die bindenden Elektronenpaare gleich verteilt, z.B. im Wasserstoff H2, im Sauerstoff O2 etc.... Es liegt eine unpolare Atombindung vor (s. Buch S. 212-213).
Bei ungleichen Bindungspartnern wird das bindende Elektronenpaar durch den elektronegativeren Bindungspartner stärker angezogen und etwas in seine Richtung gerückt. Es liegt ein polare Atombindung vor. Im Molekül hat der elektronegativere Partner eine partiell negative Teilladung und der schwächere Partner eine partell positive Teilladung. Bei gewinkelten Molekülen wie dem Wasserteilchen entsteht dadurch ein Dipol, da in ihnen die Ladungsschwerpunkte nicht übereinander liegen.
Dies ist die Grundlage der erstaunlichen Eigenschaften von Wasser, wie z.B. den für die Molekülmasse ungewöhnlich hohen Siede- und Schmelzpunkt, die Oberflächenspannung, die höchste Dichte bei 4°C im flüssigen Aggregatzustand (!) statt als Feststoff ( => Volumenzunahme beim Gefrieren ---> platzende Wasserleitungen ...), gutes Lösungsmittel für Ionenverbindungen / Salze ... , siehe Buch S. 214 - 217.
Videos hierzu:
Die Oberflächenspannung von Wasser haben wir wahrscheinlich alle schon im Schwimmbad erlebt. Beim Bauch- oder Rückenplatscher schlagen wir aus größerer Höhe großflächig mit einer Hautfläche auf die Wasseroberfläche auf. Das erzeugt heftigen Druckschmerz (und Hautrötung), da die Wasseroberfläche einigen Widerstand gegen das Eindringen erzeugt, und damit eine große Gegenkraft ausübt. Beim Kopfsprung dagegen hat unser Körper eine sehr viel kleine Auftreffoberfläche und "schneidet" / durchtrennt dadurch mit großer Kraft die Wasseroberfläche.
Die Wasserteilchen an der Wasseroberfläche werden von sogenannten Wasserstoffbrücken zusammen gehalten / vernetzt. Der nächste Film erklärt sie: Wasser und Wasserstoffbrücken zwischen Wassermolekülen.
BRalpha Film: https://www.br.de/alphalernen/faecher/physik/7-wasser-anomalie-waermelehre-102.html
Metallbindung
Eine dritte Art von Bindung zwischen Atomen findet man in den Metallen. Metalle sind im festen und geschmolzenen Zustand gute elektrische Leiter. Daher müssen sie frei bewegliche elektrische Ladungsträger (z.B. Elektronen) enthalten. Durch das einander Anlagern der einzelnen ungeladenen Metallatome entstehen im festen Metall offenbar frei bewegliche Ladungsträger.
Man kann sich dies so vorstellen: Die nur locker gebundenen Valenzelektronen auf der äußersten belegten Elektronenschale werden von den Metallatomen in den leeren Raum zwischen den Atomen abgegeben. Sie sind dort frei beweglich und bilden das so genannte Elektronengas, das die verbleibenden positiv geladenen Atomrümpfe (bestehend aus dem Atomkern und allen inneren Elektronenschalen) umgibt und die Abstossungskräft zwischen den Atomrümpfen kompensiert und sie dadurch zusammen hält.
Die Elektronen des Elektronengases sind leicht verschiebbar, so dass Metalle auch als Feststoff den elektrischen Strom gut leiten.
Welche Bindungsart liegt in einer Verbindung vor?
Welche Bindungsart in einer Verbindung vorliegt kann man aufgrund ihrer Eigenschaften erkennen. Leitfähigkeit im festen, flüssigem und gasförmigen Zustand findet man bei Metallen, aber nicht bei Salzen oder Verbindungen mit Elektronenpaarbindungen. Salze sind nur im flüssigen oder gasförmigen Zustand elektrische Leiter. Verbindungen mit Elektronenpaarbindungen sind selten elektrisch leitfähig.
Falls aber die Eigenschaften einer Verbindung nicht bekannt sind kann man sich mit einer Faustregel behelfen:
- Liegt der Unterschied der Elektronegativität der Bindungspartner zwischen 0 und größer / gleich 0,4, so liegt eine unpolare Elektronenpaarbindung / Atombindung vor. Der Stoff gehört zu den unpolaren Molekülverbindungen und ist elektrischer Nichtleiter.
- Liegt der Unterschied der Elektronegativität der Bindungspartner zwischen 0,41 und 1,7, so handelt es sich um eine polare Elektronenpaarbindung / Atombindung.
- Bei einem Unterschied der Elektronegativität der Bindungspartner größer als 1,7 liegt eine Ionenverbindung / salzartige Verbindung mit Ionenbindung vor.
Zusammenfassung:
unpolare Elektronenpaarbindung < = 0,4 polare Elektronenpaarbindung < = 1,7 Ionenbindung
Einfach ätzend: Säuren und Laugen
Das hier gezeigte Experiment funktioniert übrigens genauso gut mit Zitronensaft. Woran könnte dies liegen?

Aus Rotkohl wird beim kochen Blaukraut oder Rotkraut, je nach Rezept.
Bei Zugabe eines Apfels oder irgendwie andersartiger Zufuhr von Säure entsteht aus Rotkohl beim kochen Rotkraut. Beim Kochen in Wasser entsteht dagegen Blaukraut. Der Farbstoff im Rotkohl ändert seine Farbe pH-abhängig. Bei stark alkalischen pH wird er grün!
Der wässrige Saft von gekochten Rotkohl eignet sich als Indikator ("Anzeigemittel") zum Nachweis von Säure und zur pH-Bestimmung. Oben siehst Du eine Reihe mit von links nach rechts steigenden pH-Wert. Auf den Schilderchen stehen die Konzentrationen eines bestimmten typischen Ions in Wasser.
Der folgende Film zeigt ein Schülerexperiment zur Herstellung und Verwendung des Rotkohlindikators.
Eine Aufstellung der typischen Eigenschaften von Säuren findet man hier.
Beispiele von Säuren aus unserem Alltag zeigt die folgende Abbildung.

Doch woran erkennt ein Indikator aber eigentlich eine Säure / saure Lösung? Auffälligerweise enthalten alle Säuren mindestens ein Wasserstoffatom, das über eine polare Atombindung an ein anderes Atom, z.B. Sauerstoff- oder ein Halogenatom wie Fluor oder Chlor, gebunden ist.
Leitfähigkeitsexperimente mit Zitronensäure und HCl zeigen, dass erst beim Kontakt von Säure mit Wasser durch eine chemische Reaktionen des Säuremoleküls mit dem Wasser Ionen und eine saure Lösung (pH < 7) entstehen. Die Ionenbildung ist durch das Auftreten von elektrischer Leitfähigkeit erst nach dem Lösen der Säure in Wasser erkennbar (geschmolzene Zitronensäure leitet den elektrischen Strom nicht!).
HCl-Springbrunnenversuch-Video mit der R9a (Video-Chat) bei Youtube
Bitte Video ansehen!
HCl-Springbrunnenversuch-Video bei Youtube (Fremdfilm)
Der Springbrunnenversuch mit HCl-Gas zeigt, dass sich HCl-Gas sehr gut in Wasser löst. Ein Indikator im Wasser zeigt zudem, dass hierbei durch eine chemische Reaktion eine saure Lösung entstanden ist. Das HCl-Molekül zerfällt (der Chemiker sagt hierzu "es dissoziiert") bei der Reaktion mit Wasser in ein positiv geladenes Hydronium-Kation und ein Chlorid-Anion (s.o.).
Die Dissoziation von HCl-Molekülen
Das Hydronium-Kation lässt sich nachweisen, indem man elektrischen Gleichstrom durch eine beliebige saure Lösung leitet. An der negativ geladenen Elektrode, der Kathode, entsteht bei allen sauren Lösungen ein Gas, das sich durch die Knallgasprobe als Wasserstoff identifizieren lässt.
Das Hydronium-Kation ist in allen sauren Lösungen enthalten und exakt dieses Teilchen wird vom pH-Indikator erkannt (detektiert).

Entstehung von Säuren / Sauren Lösungen
Zwei wesentliche Wege zur Herstellung von Säuren gibt es:
1) Säuren entstehen durch die Reaktion von Wasserstoff und Halogen und die Lösung des Halogenwasserstoffes in Wasser.
Beispiel: Wasserstoff und Chlor reagieren in der Chlorknallgasreaktion zu Chlorwasserstoff (HCl). Dieser wird dann gelöst in Wasser (siehe Salzsäurespringbrunnen) und dies ergibt Salzsäure.
Durch Bildung von Halogenwasserstoffen und lösen der Produkte in Wasser lassen sich auch die anderen Halogenwasserstoffsäuren und saure Lösungen dieser Säuren herstellen: Wasserstoff und Fluor ----> Fluorwasserstoff (HF). Dieser reagiert mit Wasser zur verdünnten Flusssäure, Wasserstoff und Brom ----> Bromwasserstoff (HBr). Dieses reagiert mit Wasser zur verdünnten Bromwasserstoffsäure ....
Die zweite Möglichkeit zur Herstellung von Säuren kennt Ihr bereits aus dem letzten Schuljahr. Da haben wir uns ein Umweltproblem aus den 90-igern angesehen - Waldsterben durch Sauren Regen.
Saurer Regen entsteht durch den Schwefelgehalt fossiler Brennstoffe, z.B. Erdöl und Kohle. Bei Verbrennung von Schwefel in Sauerstoff oder Luft entsteht als Produkt das Gas Schwefeldioxid. Dieses reagiert mit Wasser zu Schwefliger Säure, wie in den folgenden Bildern und im Film der Farbumschlag des pH-Indikators von grün nach gelb zeigt.
Wie die unten folgenden Bilder zeigen, reagieren Pflanzen sehr empfindlich auf die Einwirkung der Säure (jeweils rechts im Bild, zur Vergrößerung bitte auf die Bilder klicken). Hier wurde der Schwefel in einer Glasglocke verbrannt, in der sich Gartenkresse (das ist die grüne Pflanze) befindet und dann in der jetzt Schwefeldioxid-haltigen Atmosphäre mit einer Sprühflasche Regen simuliert.
Im Kontrollexperiment (jeweils links) wurde bis auf das Verbrennen des Schwefels alles gleichartig gemacht.
Säuren entstehen also auch durch die Reaktion von Nichtmetalloxiden mit Wasser. Zum Beispiel:
1a) Schwefel (s) + Sauerstoff (g) -----> Schwefeldioxid (g)
S (s) + O2 (g) -----> SO2 (g)
1b) Schwefeldioxid (g) + Wasser (l) -----> Schweflige Säure (l)
SO2 (g) + H2O (l) ------> H2SO3 (l)
2a) Kohlenstoff (s) + Sauerstoff (g) -----> Kohlenstoffdioxid (g)
C (s) + O2 (g) -----> CO2 (g)
2b) Kohlenstoffdioxid (g) + Wasser (l) -----> Kohlensäure (l)
CO2 (g) + H2O (l) ------> H2CO3 (l)
Phosphor und Stickstoff reagieren auf ähnliche Weise zur Phosphorsäure und Salpetersäure.
Säuren bilden sich aus den Halogenwasserstoffen oder Nichtmetalloxiden (Säureanhydriden) bei ihrer Reaktion mit Wasser.
Dissoziation der Säuren in Ionen
In Wasser zerfallen die Säuremoleküle in Ionen. Das oben bereits erwähnte H+ / H3O+ - Ion und das jeweilige säuretypische Säurerestion, z.B.
HCl + H2O -------> H3O+ + Cl-

Der pH-Wert - was ist das eigentlich genau?
Der pH-Wert ist der negative dekadische Logarithmus (= „Zehnerlogarithmus“) der Wasserstoffionen-Konzentration , d.h. der H+ / H30+-Konzentration in der sauren Lösung / Säure:
Man denke daran, dass der log von 10 hoch x = x ist und somit der negative dekadische Logarithmus von 10 hoch -1 folglich gleich 1 ist. Dadurch wird der pH umso größer, je kleiner die Konzentration der H+ / H3O+ - Ionen in der sauren Lösung / Säure ist.
---> Je kleiner der pH, desto höher ist die Konzentration der saure Lösung / Säure.
Starke Säuren dissoziieren (zerfallen) völlig in H3O+ -Ionen und Säurerestionen, schwache Säuren wie die Essigsäure dagegen nur teilweise.
Säuren sind unterschiedlich stark!
Wie sauer eine wässrige Säurelösung ist, ist abhängig von der Stoffmengenkonzentration (angegeben in mol pro Liter) der Säure und ihrem typischen Dissoziationsgrad, d.h. wie häufig die Säuremoleküle dieser Säure in die sauren H3O+-Ionen und die Säurerestionen zerfallen. So zeigt eine 0,1 mol pro Liter konzentrierte Salzsäurelösung den pH-Wert 1, eine gleich stark konzentrierte Essigsäurelösung dagegen aufgrund geringerer Dissoziation (nur ca. 1% der Essigsäuremoleküle zerfallen im Wasser in Ionen) nur den pH-Wert 3. Essigsäure ist also eine schwache, Salzsäure wegen ihrer vollständigen Dissoziation dagegen eine sehr starke Säure.
Es gilt für die Säurestärke: Salzsäure > Schwefelsäure > Salpetersäure >> Phosphorsäure > Essigsäure >> Kohlensäure.
Säure-Steckbriefe
Salzsäure entsteht z.B. wenn man durch die sehr exotherme Chlorknallgasreaktion aus Wasserstoff und Sauerstoff Chlorwasserstoffgas herstellt, siehe https://www.youtube.com/watch?v=GXFpKv5zRW8, und in dieses in Wasser löst. Das ätzend wirkende Chlorwasserstoffgas ist schwach gelb-grünlich gefärbt. Es löst sich extrem gut in Wasser, siehe HCl-Springbrunnen -Film und den längeren Film mit Unterrichtsgespräch. Dabei bildet sich Salzsäure. Unsere Magensäure ist übrigens verdünnte Salzsäure.
Schwefelsäure wird z.B. durch einleiten von SO3- (Schwefeltrioxid-) Gas in Wasser hergestellt. Die Säure ist sehr materialzerstörend, da sie sehr
stark oxidierend und wasserentziehend wirkt. Dazu habt ihr die Reaktion von konzentrierter Schwefelsäure mit Baumwolle gesehen. Wo Schwefelsäure auf die Baumwolle gekommen war entstanden nach
wenigen Sekunden Löcher mit schwarzen Rand. Wenn man Schwefelsäure auf Zucker tropft entsteht in einer sehr exothermen Reaktion mit Kohlenstoffdioxid-Gasbläschen durchsetzte Zuckerkohle, siehe
Film! Schwefelsäure H2SO4 (die Zahlen müssten jeweils klein unten rechts am Buchstaben vorherigen stehen, aber das kann man hier nicht machen) kann zweimal ein H+ (Proton) abspalten. Die Salze
der Schwefelsäure nach vollständiger Protonenabgabe heißen Sulfate. Wichtig ist richtiges Verdünnen der Säure: Gibst Du Wasser in die Säure dann geschieht das Ungeheure! (Es erhitzt sich
so stark, dass die stark ätzende Säure durch Siedeverzüge und verdampfendes Wasser durch die Gegend spritzt). Also immer die Säure in das Wasser gießen, dann passiert
nichts!
Salpetersäure HNO3 ist eine sehr stark oxidierende Säure, die wichtig für die Sprengstoff- und Düngemittelherstellung ist. Gemischt mit Salzsäure erhält man Königwasser, in dem sich sogar Gold lösen lässt. Hier gibt es mehr Informationen zu dieser Säure.
Phosphorsäure H3PO4 findet in der Lebensmittelindustrie Verwendung als Konservierungs- und Säuerungsmittel - schau einmal auf Deine Colaflasche, oder auf die Zusatzstoffliste Deiner Imbissbude! Ihre Salze sind die Phosphate, die für die Pflanzendüngung gebraucht werden. Hier gibt es mehr Informationen zu dieser Säure.
Laugen
Der Ammoniakspringbrunnen: Ammoniakgas reagiert mit Wasser zu einer Lauge
Wir haben im Unterricht gesehen, dass sich Ammoniakgas NH3 (g) sehr gut in Wasser löst. Dabei zeigte uns der dem Wasser zugefügte Indikator, dass im Gegensatz zum HCl-Springbrunnen diesmal eine alkalische Lösung entstanden ist (Experiment im Film anschauen). Die Hydroxidionen können nur durch Protonenübertragung von einem Wassermolekül auf das Ammoniakmolekül entstanden sein.
NH3 + H20 ---> NH4+ + OH-
Auch beim Lösen von NaOH, LiOH, Mg(OH)2 und anderen Hydroxiden in Wasser lässt sich eine Blaufärbung des Indikators Bromthymolblau beobachten. Es ist eine alkalische Lösung, eine Lauge, entstanden. Da alle Metallhydroxide (MeOH) beim auflösen in Wasser alkalische Lösungen entstehen lassen, muss dies auf die Hydroxidgruppe OH- zurückzuführen sein.
Möglichkeiten zur Herstellung alkalischer Lösungen:
1.) Einfachster Weg: Auflösen eines Metallhydroxides in Wasser.
2.) Unedle Metalle und Wasser. Unedle Metalle wie z.B. die Alkalimetalle Li, Na, K .... reagieren mit Wasser zu alkalischen Lösungen und Wasserstoff, siehe Reaktion der Alkalimetalle Li bis Cs mit Wasser (FILM).
3.) Metalloxide lösen sich in Wasser unter Bildung alkalischer Lösungen.
4.) Ammoniakgas in Wasser einleiten.
Basen bestehen nach der erweiterten Säure-Base-Theorie von Bronsted und Lowry aus Molekülen, welche ein Proton (H+) an sich binden können. Sie sind Protonenakzeptoren. Für die Bindung des Protons brauchen sie ein freies Elektronenpaar.
Nach Bronsted und Lowry sind Säuren dagegen Stoffe, die ein H+ (Proton) abgeben können. Sie sind Protonendonatoren (Protonenspender). Für die Abspaltung als H+ muss das H-Atom über eine polare Atombindung gebunden sein. Über eine unpolare Atombindung gebundene H-Atome lassen sich nicht abspalten! Methan (CH4) enthält vier H-Atome und ist trotzdem keine Säure!
Neutralisation
Zusammengeben von Säure und Lauge führt zur Neutralisation. Gibt man zu einer sauren Lösung, z.B. Salzsäure HCl(aq), mit dem Indikator Bromthymolblau langsam eine Lauge, z.B. Natronlauge (Na+(aq) und OH-(aq)), so beobachtet man Erwärmung und einen Farbumschlag von gelb zu grün und mit noch mehr Lauge schließlich zu blau. Diese Beobachtung zeigt, dass H30 + / H+-Ionen verschwinden. Sie reagieren mit den Hydroxidionen (OH-) zu ungeladenen Wassermolekülen. Zurück bleiben die gelösten Restionen der Säure und Lauge, die beim Abdampfen des Wasser Salz, hier Kochsalz NaCl, bilden. Bei der Neutralisation entsteht Wärme, Wasser und ein Salz.
Virtuelle Titration I: https://www.seilnacht.com/Analyse/titrier.htm
Interaktives Titrieren am PC / Handy https://kappenberg.com/akminilabor/apps/titrationstrainer.html#titrationstrainer-game
Die chemische Wertigkeit hilft beim Ermitteln von Verbindungsformeln
Die Wertigkeit ist ein Hilfsmittel zur Formelermittlung von Verbindungen. Das folgende Video erklärt, wie es geht. Unter der Video ist noch eine schriftliche Arbeitsanleitung mit einem etwas anderen, aber genauso gut funktionierenden Weg. Wie ihr es macht ist Eure Sache - jeder wie er will.
Wertigkeit ermitteln
Zu ihrer Ermittlung brauchen wir ein Periodensystem der Elemente (PSE), denn die Wertigkeit steht im Zusammenhang mit der Hauptgruppenzugehörigkeit.
Wir erhalten durch Anwendung der Wertigkeit die hinter dem jeweiligen Symbol in der Formel kleingeschrieben notierten Indexzahlen.
Die Wertigkeit gibt an,
- wie viele Wasserstoffteilchen das Teilchen eines Elementes in einer Verbindung ersetzen kann (positive Wertigkeit, z.B. Na hat die Wertigkeit +I, Be die Wertigkeit +II, Al die Wertigkeit +III ... Sie entspricht bei den Hauptgruppen I-III der Hauptgruppennummer.
- oder wie viele Wasserstoffteilchen es in einer Verbindung an sich binden könnte (negative Wertigkeit = Abstand zur Hauptgruppe VIII, z.B. Sauerstoff (VI. Hauptgruppe, Wertigkeit: VI-VIII = -II, C ist in der IV. Hauptgruppe, Wertigkeit IV - VIII = -IV).
Bei einer richtigen Formel für eine Verbindung ist die Summe der Wertigkeiten aller beteiligter Teilchen = 0. Siehe auch: Artikel zur Wertigkeit bei Wikipedia.
Beispiele:
1) Formel für Natriumchlorid?
Na ist in der ersten Hauptgruppe ----> Wertigkeit +I
Chlor ist in der siebten Hauptgruppe ----> Abstand zur achten Hauptgruppe => VII - VIII = -I
+I und -I ergibt 0 => wir brauchen jeweils 1 Atom Na und ein Atom Cl: NaCl
2) Formel für Lithiumoxid?
Li ist in der ersten Hauptgruppe ---> Wertigkeit +I
Sauerstoff ist in der sechsten Hauptgruppe ---> Abstand zur achten Hauptgruppe => VI - VIII = -II
Hier wendet man zum Herausfinden der Zahlen das kleinste gemeinsame Vielfache an: I und II haben zwei als kleinstes gemeinsames Vielfaches.
2x +I ergibt +2 und 1x -II ergibt -2. Die Summe daraus ist 0 => wir brauchen jeweils 2x Li und 1x O:

3) Formel für Alumiiniumoxid?
Aluminium ist in der dritten Hauptgruppe ---> Wertigkeit +III
Sauerstoff ist in der sechsten Hauptgruppe ---> Abstand zur achten Hauptgruppe => VI - VIII = -II
Hier wendet man zum Herausfinden der Zahlen das kleinste gemeinsame Vielfache an: II und III haben 6 als kleinstes gemeinsames Vielfaches.
Mit 2x +III und 3x -II kommt man auf 0 => wir brauchen jeweils 2x Al
und 3x O:
Al2O3
Aufstellen einer Reaktionsgleichung in Symbolschreibweise

Zur Verdeutlichung der Bedeutung der kleinen und großen Zahlen in der Reaktionsgleichung wurden für diese chemischen Reaktionen die jeweiligen Teilchenbilder der Edukte und Produkte gemalt.
Hier gibt es ein PERIODENSYSTEM DER ELEMENTE zum ausdrucken.
So geht´s: Aufstellen einer Reaktionsgleichung in Symbolschreibweise
1.) Übersetzen aller Stoffe in Symbolschreibweise
2.) Ermitteln der Verbindungsformel von Produkten (evtl. auch der Ausgangsstoffe / Edukte) mit Hilfe der Wertigkeiten.
2.) Ausgleichen einer Reaktionsgleichung - so geht´s (erklärendes Video)
Chemie 8. Klasse
Was lernt man im Chemieunterricht?
Chemie ist ein neues naturwissenschaftliches Unterrichtsfach für dich. Sie ist die Naturwissenschaft, die die stofflichen Veränderungen untersucht. Diese stofflichen Veränderungen finden bei chemischen Reaktionen statt. Eine chemische Reaktion findet zum Beispiel statt, wenn du ein Streichholz oder eine Kerze anzündest. Die Chemie erkundet die den chemischen Reaktionen zugrunde liegenden naturwissenschaftlichen Regeln.
Sicherheit im Chemieunterricht
Die Demonstrationsexperimente in den ersten Chemiestunden haben euch gezeigt, dass von chemischen Stoffen und Reaktionen erhebliche Gefahr ausgehen kann. Deshalb muss man beim Experimentieren einige Sicherheitsregeln einhalten und sich immer genau an die Arbeitsanweisungen des Chemielehrers halten. Die euch bereits aus dem Bio-Unterricht in der 5. und 6. Klasse bekannten Regeln sind im Chemieunterricht besonders wichtig. Eigenmächtiges Experimentieren kann Unfälle und Verletzungen verursachen und wird deshalb durch Ausschluss bei künftigen Schülerexperimenten unterbunden!
Richtiges Verhalten und Gefahrstoffe
Auf Behältern mit gefährlichen Stoffen warnen dich spezielle Gefahrenkennzeichen vor der jeweiligen Gefahr. Diese Kennzeichen, ihre Bedeutung und die notwendigen Sicherheitsmaßnahmen beim Umgang mit dem jeweiligen Stoff musst du lernen. Hier eine Übersicht der alten und neuen Gefahrenkennzeichen .
Zum sicheren Experimentieren gehört auch die richtige Handhabung des Teclubrenners. Ihr habt die heißeste Stelle der Flamme gesucht und Glas so weit erhitzt, dass es sich verformen lies.
Stoffeigenschaften und ihre Anwendung zur Identifizierung von unbekannten Stoffen
Allein durch die Untersuchung von Stoffen mit unseren Sinnesorganen erhalten wir viele Informationen über die Eigenschaften eines Stoffes: Aussehen (Konsistenz, Farbe, Aggregatzustand bei Raumtemperatur und Normaldruck ...), Geruch, Geschmack, Härte, usw.
Allerdings müssen wir vorsichtig sein, damit unsere Sinnesorgane dabei keinen Schaden nehmen, denn manche Stoffe haben gefährliche Eigenschaften ---> Gefahrstoffe und ihre Kennzeichnung, siehe oben!). Geschmacksproben sind deshalb im Chemieunterricht nicht erlaubt und gerochen wird auf "Chemikerart", d.h. durch zufächeln.
Viele weitere Stoffeigenschaften müssen mit Messgeräten bestimmt werden, z.B. der Schmelz- und Siedepunkt, der pH-Wert, die Dichte ...
Zu den für die Identifizierung besonders gut nutzbaren Eigenschaften gehören der Schmelzpunkt und der Siedepunkt eines Stoffes. Bei diesen stofftypischen Temperaturen wechselt ein Stoff seinen Aggregatzustand von fest nach flüssig, bzw. flüssig zu gasförmig. Der Stoff bleibt dabei der Gleiche, also z.B. Wasser. Die Eigenschaften des festen, flüssigen oder gasförmigen Stoffes lassen sich am Besten verstehen, wenn man davon ausgeht, dass ein Stoff aus kleinsten Teilchen besteht.
Animationen:
Schmelz- und Siedepunkt im
Teilchenmodell
Verhalten eines Stoffes, Aggregatzustand und Teilchenmodell
Aggregatzustände (fest, flüssig, gasförmig) und die Übergänge
Stoffe bestehen aus kleinsten Teilchen
50 ml Alkohol und 50 ml Wasser ergeben nur 97 ml Gemisch, während 50 ml Öl und 50 ml Wasser 100 ml Flüssigkeit ergeben. Was ist geschehen? Ein Modellexperiment mit Erbsen und Senfkörnern zeigt, was geschehen sein könnte: die kleineren Senfkörner sind beim mischen in die Hohlräume zwischen den größeren Erbsen gewandert. So ist es wohl auch beim Wasser und Ethanol geschehen. Da sich Wasser und Öl nicht mischen, konnte dieser Effekt hier nicht auftreten.
Löslichkeit
Auch die Löslichkeit eines Stoffes kann zur Identifizierung herangezogen werden. Salz löst sich gut in Wasser, aber nicht in Alkohol. Jod dagegen löst sich wiederum gut in Alkohol, aber nicht in Wasser. Nicht für jeden Stoff ist Wasser also ein geeignetes Lösungsmittel. Man kann die Löslichkeit (in g/100ml experimentell ermitteln indem man die maximal lösliche Stoffemenge in 100 ml Lösungsmittel zur Lösung bringt, ungelöstes entfernt und dann das Lösungsmittel durch verdampfen entfernt.
Reinstoffe, Gemische und Trennverfahren
Ihr habt anhand von Stoffbeispielen aus dem Alltag erkennen können, dass die meisten von uns benutzten Stoffe keine Reinstoffe sind, sondern Gemische verschiedener Stoffe. Tatsächlich ist eine Aufgabe von Chemikern die Aufreinigung von Stoffen aus Stoffgemischen, z.B. hochreines Silizium für den Prozessor in deinem Computer herzustellen.
Ihr habt im letzten Schülerversuch ein Verfahren zur Aufreinigung von weißem Kochsalz (der Chemiker sagt dazu NaCl) aus einem Salz-Sand-Kieselsteingemisch entwickelt und dann praktisch umgesetzt. Dann habt ihr die Farbe von Farbstiften durch das Verfahren der Chromatographie aufgetrennt. Dabei habt ihr die unterschiedliche Wanderungsgeschwindigkeit und Anhaftungsstärke der unterschiedlichen, in Wasser löslichen Farbstoffe des Stiftes genutzt.
Wir haben im Unterricht außerdem Wein in seine Bestandteile aufgetrennt. Das Verfahren nennt sich Destillation. Man nutzt die unterschiedlichen Siedetemperaturen von Alkohol, Wasser, Farbstoffen, Zucker und Aromastoffen. Hier kann man sich den Vorgang in einer Animation anschauen.
Übersicht über die Gemischarten
Kleine Übersicht über Trennverfahren
Die chemische Reaktion: Entstehung neuer Stoffe mit neuen Eigenschaften
Am Beispiel des Reaktionsproduktes der Reaktion von Eisen und Schwefel habt ihr erkannt, dass zwischen einem Gemisch (hier ein heterogenes Gemenge aus Eisen und Schwefel) und der beim Erhitzen
entstehenden Eisen-Schwefel-Verbindung Eisensulfid ein deutlicher Unterschied besteht. Eisensulfid hat nämlich völlig andere, neue Eigenschaften, während das Gemisch die
Eigenschaften von Eisen und die vom Schwefel zeigt. Außerdem konnten wir bei der durch zuführen von Aktivierungsenergie (Abkürzung E mit Index A) gestarteten Reaktion eine
Energiefreisetzung in Form von Licht und Wärme beobachten. Dies lies sich auch mit einem Streichholz und einer Wunderkerze beobachten.
Chemische Reaktion werden durch eine Reaktionsgleichung beschrieben. Ihr habt das Formulieren einer Reaktionsgleichung in Worten kennen gelernt. Die Stoffe nach der Reaktion, die Produkte, sahen jeweils anders aus als die Ausgangsstoffe, die Edukte. Es sind neue Stoffe entstanden. Bei der Reaktion eines festen Metalles mit Schwefel entsteht eine Verbindung, ein festes Metallsulfid (s):
Eisen (s) + Schwefel (s) ---> Eisensulfid (s), gelesen wird
dies "festes Eisen und der Feststoff Schwefel reagieren zu (entspricht dem Pfeil) festem Eisensulfid . Entsprechend reagieren Kupfer (s) und Schwefel (s) --->
Kupfersulfid (s)
Verhalten der Masse bei chemischen Reaktionen
Durchführen verschiedener chemische Reaktionen, z.B. die Reaktion von Kupfer und Schwefel, mit Abwiegen vor und nach der Reaktion zeigt, dass die Masse bei chemischen Reaktionen unverändert bleibt. Voraussetzung ist, dass kein Edukt oder Produkt beim Wiegen weggelassen wird. Die chemische Reaktion muss in einem geschlossenen Behälter (System) erfolgen. Die Masse wird bei chemischen Reaktionen lediglich anders verteilt, da durch die Reaktion andere Verknüpfungen der beteiligten Teilchen erzeugt werden.

8 g Schwefel reagieren mit 16 g Kupfer zu 24 g Kupfersulfid. Es geht nichts verloren. Wenn man insgesamt 24 g Ausgangsstoffe (8 g Schwefel und 16 g Kupfer = 24 g Ausgangsstoffe) zur Reaktion bringt, dann erhält man 24 g Produkt (Kupfersulfid).
Rolle der Energie bei chemischen Reaktionen
Beim Kupfervitriol haben wir die Umkehrbarkeit einer chemischen Reaktion erlebt. Außerdem ist die Reaktion vom blauen Kupfervitriol (Kupfersulfat mit chemisch gebundenen Wasser = Kupfersulfat-Pentahydrat) durch Erhitzen zum wasserfreien weißen Kupfersulfat das Paradebeispiel für eine endotherme Reaktion. Bei endothermen Reaktionen wird dem Reaktionssystem aus der Umwelt (oder durch einen Brenner) zugeführte Energie in chemisch im Produkt gespeicherte Energie umgewandelt. Gibt man zu wasserfreien weißen Kupfersulfat Wasser hinzu, so wird daraus wieder das blaue Kupfersulfat mit chemisch gespeicherten Wasser. Dabei wird Wärme frei. Diese Reaktion verläuft also exotherm, denn das Reaktionssystem gibt Energie an die Umwelt ab.
Merkhilfe / Eselsbrücke: Export bezeichnet die Ausfuhr von Waren, exotherm die Ausfuhr (Abgabe) von Energie (Wärme) bei chemischen Reaktionen.
Kurzbeschreibung des Experimentes mit Bildern
Energiediagramme der exothermen und endothermen Reaktion
Wir haben dann noch die Wirkung eines Katalysators bei der Reaktion von Wasserstoff mit Sauerstoff im Experiment erlebt und im Energiediagramm
betrachtet. Einen Film zur Wirkung eines Katalysators findet ihr auf der Seite zum Informationstag der Kopernikusschule.
Zusammenfassung
Eigenschaften der Luftgase und Zusammensetzung der Luft
Luft, ihre Zusammensetzung und die Eigenschaften der Luftgase
Wir haben die Eigenschaften der in Luft enthaltenen Gase experimentell untersucht. Die Eigenschaften von Kohlenstoffdioxid sahen wir sowohl beim Gas, als auch beim Trockeneis. Die Zusammensetzung der Luft haben wir mit Hilfe von Stahlwolle untersucht, die angefeuchtet mit verschiedenen Gasen oder Luft in einem Reagenzglas stehend im Wasserbad luftdicht abgeschlossen eine Woche aufbewahrt wurde. Bei Stickstoff blieb der Wasserstand im Reagenzglas unverändert und die Wolle sah fast unverändert aus, bei reinem Sauerstoff füllte sich das Reagenzglas vollständig mit Wasser und die Stahlwolle war teilweise braun-schwarz verfärbt. Bei Luft strömte ungefähr ein Fünftel Wasser ins Reagenzglas, während es sich bei einem Gasgemisch aus 50% Sauerstoff und 50% Stickstoff ungefähr halb voll mit Wasser füllte. Das verbliebene Luftgas erstickte einen brennenden Holzspan und reagierte nicht mit Kalkwasser. Wir schlussfolgerten, dass ein Bestandteil der Luft, offenbar Sauerstoff, mit der Stahlwolle reagiert hat. Unsere Ergebnisse zeigten weiterhin, dass Luft aus ca. 20% Sauerstoff und 80% Restgas (hauptsächlich Stickstoff) besteht.
Wie bekommt man reinen Sauerstoff, Stickstoff usw. in eine Druckgasflasche?
Dazu benutzt man die von Carl von Linde entwickelte Technik der Luftverflüssigung und Destillation. Das bei der Luftverflüssigung verwendete Verfahren, die prozessbedingte Abkühlung von verdichteten Gasen oder sogar verflüssigten Gasen bei der Entspannung ist auch die technische Grundlage aller Kühl- Gefrier- und Klimaanlagen. Siehe Buch und Funktion eines Kühlschrankes.
Wie versprochen gibt es jetzt hier das Video zum Thema "Grill anzünden auf Chemiker-Art" mit flüssigen Sauerstoff ( -183°C kalt !!! ).
Das Verhalten von Stoffen bei tiefkalten Temperaturen, flüssiger Stickstoff ist -196°C kalt, wird im Video Bananenhammer gezeigt. Mehr sehenswerte Experimente mit fl. Stickstoff gibt es hier. Eine Zusammenfassung der Eigenschaften und Nutzung gibt es bei Wikipedia.
Umweltgefahren durch Spurengase (Gase mit nur kleinen Volumenanteil in der Luft)
Saurer Regen entsteht durch den Schwefelgehalt fossiler Brennstoffe, z.B. Erdöl und Kohle. Bei Verbrennung von Schwefel in Sauerstoff entsteht als Produkt Schwefeldioxid. Dieses reagiert mit Wasser zu Schwefliger Säure, wie der Farbumschlag des pH-Indikators Bromthymolblau von grün nach gelb zeigt. Wie die folgenden Bilder zeigen, reagieren Pflanzen empfindlich auf die Einwirkung der Säure des sauren Regens (jeweils rechts im Bild, zur Vergrößerung bitte auf die Bilder klicken).
Verbrennen von Kohlenstoff oder eines Metalls an der Luft: Reaktion mit Luftsauerstoff zum Kohlenstoffmono- oder Kohlenstoffdioxid bzw. Metalloxid
Bei einer typischen Verbrennungreaktion kommt es zur Reaktion eines Elementes mit Luftsauerstoff. Diese Reaktionen sind typischerweise exotherm, d.h. Wärme wird freigesetzt. Das entstehende Produkt ist abhängig vom Ausgangsstoff ein Nichtmetall- oder Metalloxid.
Beispiele:
Kohlenstoff (s) + Sauerstoff (g) -----> Kohlenstoffdioxid (g) ; exotherm
Schwefel (s) + Sauerstoff (g) -----> Schwefeldioxid (g) ; exotherm
Magnesium (s) + Sauerstoff (g) -----> Magnesiumoxid (s) ; exotherm
Kupfer (s) Sauerstoff (g) -----> Kupferoxid (s) ; exotherm
Auffällig ist dabei, dass bei Nichtmetallen oft gasförmige Oxide als Reaktionsprodukte entstehen, während die Metalle meist feste Oxide bilden.
 Naturwissenschaften an der
Kopernikusschule Freigericht
Naturwissenschaften an der
Kopernikusschule Freigericht







