Chemie G10 (Schuljahr 2021/2022)
Aufstellen einer Reaktionsgleichung in Symbolschreibweise
1) Summenformel ermitteln
Die Summenformel gibt die Zusammensetzung einer Verbindung an. Ich benutze lieber den aussagekräftigeren Begriff "Verbindungsformel".
Zuerst muss man feststellen, wie viele Teilchen eines Elementes mit wie vielen Teilchen eines zweiten Elementes in der Verbindung verbunden sind. Hierzu benutzen wir die Wertigkeit. Zu ihrer Ermittlung brauchen wir ein Periodensystem der Elemente (PSE), denn die Wertigkeit steht im Zusammenhang mit der Hauptgruppenzugehörigkeit. Letztendlich erhalten wir durch Anwendung der Wertigkeit die hinter dem jeweiligen Symbol in der Formel kleingeschrieben notierten Indexzahlen. Die Wertigkeit gibt an, wie viele Wasserstoffteilchen das Teilchen eines Elementes in einer Verbindung ersetzen kann (positive Wertigkeit, z.B. Na hat die Wertigkeit +I, Be die Wertigkeit +II, Al die Wertigkeit +III ... oder wie viele Wasserstoffteilchen es in einer Verbindung an sich binden könnte (negative Wertigkeit = Abstand zur Hauptgruppe VIII, z.B. Sauerstoff (VI. Hauptgruppe, Wertigkeit: VI-VIII = -II). Bei einer richtigen Formel für eine Verbindung ist die Summe der Wertigkeiten aller beteiligter Teilchen = 0. Siehe auch: Artikel zur Wertigkeit bei Wikipedia.
2) Koeffizienten ermitteln und einfügen
Nachdem die Verbindungsformel gefunden ist, muss die Anzahl jeder Teilchensorte auf der Eduktseite (links vom Reaktionspfeil) mit der auf der Produktseite (rechts vom Reaktionspfeil) ausgeglichen werden, denn Teilchen und Masse können weder verschwinden, noch aus dem Nichts auftauchen! Dazu verwendet man Koeffizienten (das sind die groß geschriebenen Zahlen vor den Symbolen).
In aller Kürze - so geht´s:
1.) Übersetzen aller Stoffe in Symbolschreibweise
2.) Ermitteln der Verbindungsformel von Produkten (evtl. auch der Ausgangsstoffe / Edukte) mit Hilfe der Wertigkeiten. ---> hier werden die kleinen Zahlen (Indexzahlen) IN DER FORMEL ermittelt.
Immer beachten: Die Elemente H, N, O, F, Cl, Br, I kommen als zweiatomige Moleküle vor, also H2, N2, O2 .... (die zwei sollte hier jeweils klein unten rechts am Symbol stehen - geht hier leider technisch nicht)
3.) Ausgleichen der Reaktionsgleichung - so geht´s (erklärendes Video) -----> Beim Ausgleichen werden die GROßEN Zahlen innerhalb der Reaktionsgleichung VOR den Formeln der Verbindungen oder Elementen ermittelt.

Zur Verdeutlichung der Bedeutung der kleinen und GROßEN Zahlen in der Reaktionsgleichung wurden für diese chemischen Reaktionen die jeweiligen Teilchenbilder der Edukte und Produkte gemalt (für Vergrößerung bitte Bild anklicken).
Stöchiometrisches Rechnen
Die Reaktionsgleichung teilt uns mit, wie viele Teilchen bei einer chemischen Reaktion jeweils miteinander reagieren. Bei der Reaktion von Mg und Schwefel reagieren 1 Teilchen Mg (Wertigkeit +II) und ein Teilchen Schwefel (Wertigkeit -II) zu Magnesiumsulfid MgS.
Mg + S ----> MgS
Die Reaktionsgleichung gilt auch für größere Teilchenzahlen von z.B. 1000 Teilchen Mg. 1000 Teilchen Mg reagieren also mit 1000 Teilchen Schwefel zu 1000 Teilchen MgS und 1 mol (6,023 x 10 hoch 23) Mg-Teilchen und 1 mol (6,023 x 10 hoch 23) S-Teilchen reagieren zu 1 mol (6,023 x 10 hoch 23) MgS. Große Teilchenzahlen fasst man unter dem Begriff Stoffmenge (Abkürzung n) mit der Einheit mol zusammen.
Eine Stoffmenge n von 1 mol enthält 6,023 x 10 hoch 23 Teilchen, also 602.300.000.000.000.000.000.000 Teilchen.
1 mol Mg-Teilchen haben die Masse 24,3 g, 1 mol S-Teilchen wiegen 32 g. Das Molgewicht MG von Mg beträgt also 24,3 g/mol, das Molgewicht MG von S ist 32 g/mol. Hier findet sich das Gewicht des einzelnen Stoffteilchens wieder, allerdings jetzt mit der Einheit g (Gramm) statt u (atomare Masseneinheit) , da ein Mol 602.300.000.000.000.000.000.000 Teilchen enthält und 1g = 602.300.000.000.000.000.000.000 u entspricht.
Was wir gerade gemacht haben nennt man stöchiometrisches Rechnen:
"Die Stöchiometrie (...) ist ein grundlegendes mathematisches Hilfsmittel in der Chemie. Mit ihrer Hilfe werden aus der qualitativen Kenntnis der Reaktanten und Produkte einer Reaktion die tatsächlichen Mengenverhältnisse (Reaktionsgleichung) und Stoffmengen berechnet." Zitiert von www.de.wikipedia.org/wiki/Stöchiometrie
Mengenberechnung für chemische Reaktionen
(1) Stoffmenge n (mol) = Stoffportion m (g) : Molgewicht MG (g/mol)
Nach Umformung erhalten wir durch Multiplikation mit dem Molgewicht MG auf beiden Seiten des Gleichheitszeichens und Kürzen für die Stoffportion mit der Masse m die Gleichung:
(2) Stoffportion m (g) = Stoffmenge n (mol) x Molgewicht MG (g/mol)
Wieviel Schwefel muss man verwenden, damit 12,15 g Magnesium vollständig zu MgS umgewandelt werden können?
1 Mg + 1 S ----> 1 MgS
Zuerst die Stoffmenge n für 12,15 g Mg mit Gleichung 1 ausrechnen:
Hat man eine Stoffportion m von 12,15 g Magnesium, so enthält diese eine Stoffmenge n = 12,15 g : 24,3 g/mol = 0,5 mol.
Um diese Stoffmenge n bei einem Reaktionsverhältnis von 1:1 (ein Teilchen Mg reagiert mit einem Teilchen S, siehe Koeffizienten = große Zahlen vor Mg und S in der Reaktionsgleichung) vollständig reagieren zu lassen braucht man daher gleich viel Schwefel, also 0,5 mol Schwefel.
Jetzt mit Gleichung 2 die Stoffportion für 0,5 mol S ausrechnen:
Eine Stoffmenge n von 0,5 mol Schwefel entspricht einer Stoffportion (Masse) m von 0,5 mol x 32 g/mol = 16 g Schwefel.
Ergebnis: 12,15 g Mg reagieren mit 16 g S vollständig zu MgS.
Kontrolle: Laut den Koeffizienten in der Reaktionsgleichung muss die gleiche Stoffmenge MgS entstehen, wie die eingesetzten Stoffmengen von Magnesium und Schwefel. In unserem Fall wurden jeweils 0,5 mol Schwefel und 0,5 mol Magnesium zu 0,5 mol Magnesiumsulfid umgesetzt. Das Molgewicht MG von Magnesiumsulfid ist 24,3 g/mol + 32 g/mol = 56,3 g/mol. Die Stoffmenge 0,5 mol Magnesiumsulfid hat eine Masse von
m = n x MG MgS = 0,5 mol x 56,3 g/mol = 28,15 g. 12,15g Mg und 16g S reagieren also zu 28,15g MgS (siehe Ergebnis oben. Denkt auch an die Masseerhaltung: in der Chemie geht nichts verloren!)
Organische Chemie
Bei der Elementaranalyse von Methan zeigten die Verbrennungsprodukte Wasser und Kohlenstoffdioxid, das Kohlenwasserstoffe aus Kohlenstoff und Wasserstoff aufgebaut sind. Weitere in organischen Verbindungen oft vorkommende Atomsorten sind Sauerstoff und Stickstoff.
Die einfachsten organischen Verbindungen sind die kettenförmigen Alkane. Sie enthalten unterschiedlich viele Kohlenstoffatome und bilden eine homologe Reihe: CH4 (Methan), C2H6 (Ethan), C3H8 (Propan), C4H10 (Butan) .... Ihre allgemeine Summenformel lautet CnH2n+2. Ihr habt die besonderen Eigenschaften der Alkane kennen gelernt und aufgeschrieben.
Vielfalt durch viele Verknüpfungsmöglichkeiten für C, H, O, N und andere Elemente
Für die Summenformel (C4H10), das Butan, gibt es mehr als eine Strukturformel. Man kann ein kettenförmiges und ein verzweigtes Molekül bauen. Beim Pentan sind schon 3 verschiedene Strukturen möglich und beim C20H42 schon 366.319 ! Diese Strukturvielfalt nennt man ISOMERIE.
Einfach-, Doppel- und Dreifachbindungen
Organische Verbindungen können Mehrfachbindungen zwischen Kohlenstoffatomen enthalten. Zwischen Kohlenstoff sind Zweifach- / Doppelbindungen und Dreifachbindungen möglich. Kohlenstoffverbindungen mit Doppelbindungen heißen Alkene, z.B. Ethen, Propen und solche mit Dreifachbindung Alkine, z.B. Ethin.
Die Alkane werden auch als gesättigte Kohlenwasserstoffe bezeichnet, da sie die maximale mögliche Anzahl an Wasserstoffatomen enthalten. Alkene und Alkine mit Mehrfachbindungen sind demzufolge ungesättigte Kohlenwasserstoffe.
Namensgebung bei Kohlenwasserstoffen und davon abgeleiteten organischen Verbindungen
Video zur Namensgebung bei einfachen Kohlenwasserstoffen (Alkanen)
Video zur Namensgebung bei etwas anspruchsvolleren Kohlenwasserstoffen (z.B. Alkene, Alkine ...)
Chemie im 9. Schuljahr
Am Anfang des neunten Schuljahres werden die Inhalte der 8. Klasse wiederholt: Was habt ihr bisher über Chemie und chemische Reaktionen gelernt?
Wer noch einmal nachschauen möchte oder muss: die Inhalte der achten Klasse findet ihr hier.
Einige chemische Verhaltensweisen und Gesetze habt ihr ja bereits kennen gelernt. Das Thema Atombau in diesem Schuljahr wird Euch verstehen lassen, warum die Stoffe so reagieren, wie wir es im Experiment jeweils beobachtet haben.
Atombau
Erste Ideen zum Aufbau der Materie stammen von den alten Griechen Demokrit und seinem Lehrer Leukipp: Sie erdachten das Atom (von atomos = unteibar (griechisch) in einem Gedankenexperiment. Etwas später führte Aristoteles mit seiner "Vier Elemente" (Feuer, Wasser, Erde und Luft) -Theorie alle erstmal jahrhundertelang völlig auf den falschen Weg!
Schließlich kam der britische Naturforscher John DALTON und räumte 1808 mit diesem Fehlglauben ordentlich auf. Dalton griff Demokrits Gedanken wieder auf und erweiterte dessen Atommodell.
Er postulierte:
1) Materie besteht aus Atomen, kleinen und unteilbaren Teilchen.
2) Die verschiedenen chemischen Grundbausteine (= Elemente) bestehen jeweils aus einer für sie typischen Atomsorte, d.h. Eisen aus Eisenatomen, Gold aus Goldatomen ....
3) Eisen- und Goldatome haben jeweils ein unterschiedliches, für dieses Element typisches Gewicht und Größe.
4) Die Atome unterschiedlicher Atomsorten können sich fest zu Atomgruppen, die dann neue Stoffe sind, verbinden.
Nach dem Rutherford´schen Atommodell bestehen Atome aus einem Atomkern und einer Atomhülle. Der Atomkern enthält die positiv geladenen Protonen und die ungeladenen Neutronen, während die Atomhülle nur die fast masselosen, negativ geladenen Elektronen enthält.
Atombau nach Rutherford im Film (musstewissen-Reihe)
Atombau interaktiv:
Im Detail: Was geschieht beim Versuch auf der Atomebene?
Interaktive Animation (unbedingt die Auslassöffnung der Strahlenquelle „Slit width“ vergrößern und beobachten was geschieht !! )
Das Ergebnis des Rutherford´schen Streuexperimentes
Aufbau der Elektronenhülle
Nach dem Atommodell von Niels Bohr existieren in der Atomhülle einzelne Energieniveaus für Elektronen, die wir uns wie Schalen vorstellen können. Der Kern ist von maximal sieben unterschiedlich großen Elektronen-enthaltenden Schalen umgeben, welche zusammen die Atomhülle bilden. Die negativ geladenen Elektronen unterschiedlicher Schalen besitzen unterschiedliche Energie, da sie dem Anziehungsfeld des positiv geladenen Atomkerns verschieden stark ausgesetzt sind. Die Elektronen werden von der Natur nach bestimmten Regeln auf die unterschiedlichen Schalen verteilt.
Film zum Schalenmodell nach Bohr (musstewissen-Reihe)
Film zum Periodensystem und Atombau (musstewissen-Reihe) und Teil 2
Aufbau des Atoms aus Elementarteilchen (Protonen, Neutronen und Elektronen)
Eigenschaften der Alkalimetalle (Elemente der 1.Hauptgruppe)
Die Elemente der 1. Hauptgruppe (Alkalimetalle) Lithium, Natrium, Kalium, Rubidium, Cäsium und Francium (radioaktiv) zeigen typische Eigenschaften von Metallen, z.B. hohe elektrische Leitfähigkeit, gute Wärmeleitfähigkeit, gute Verformbarkeit und metallischen Glanz. Sie sind sehr weich und zeigen ähnliches chemisches Reaktionsverhalten. Sie reagieren mit Wasser heftig exotherm. Dabei entsteht jeweils Wasserstoff und eine Lauge. Sie haben eine hohe Sauerstoffaffinität. An der Luft überziehen sich die glänzenden Schnittflächen sofort mit einer Oxidschicht.
Filme:
Reaktion der Alkalimetalle Li bis Cs
mit Wasser (Sodium = englische Bezeichnung für Natrium, Potassium = Kalium)
Reaktionsverhalten der Alkalimetalle Li bis Cs mit Wasser (spektakuläres BRAINIAC Video)
Eigenschaften der Halogene (Elemente der 7.Hauptgruppe)
Durch Reaktion von Kaliumpermanganat und Salzsäure haben wir gelbgrünes Chlorgas erzeugt und seine Eigenschaften, z.B. die bleichende Wirkung auf das Chlorophyll eines grünen Laubblattes kennen gelernt. Die Halogene haben als Nichtmetalle relativ niedrige Schmelz- und Siedepunkte, sind farbig, bestehen aus zweiatomigen Teilchen ("Zwillingsteilchen") und sind sehr reaktiv. Fluor und Chlor sind bei Raumtemperatur und Normaldruck gasförmig, Brom ist flüssig und Iod ein Feststoff. Alle Halogene sind im gasförmigen Zustand schwerer als Luft.
Als nächstes haben wir Chlor mit Natrium reagieren lassen. Video einer Reaktion von Natrium und Chlor . Bei der stark exothermen Reaktion entsteht unter grellgelber Lichtabstrahlung ein weißer Feststoff, das uns bestens bekannte Natriumchlorid (Kochsalz).
Ionenverbindungen und ihre typischen Eigenschaften
Mit dem Wissen über den Atombau kommen wir jetzt noch einmal zurück zur Reaktion von Natrium und Chlor. Der folgende Filmstreifen zeigt, was bei der chemischen Reaktion auf der atomaren Ebene geschieht.
Ergebnis: Bei der Reaktion entstehen durch Elektronenübertragung vom Natrium zum Chlor geladene Atome, die man Ionen nennt. Positiv geladene Ionen wie die Natrium-Ionen heißen Kationen und negativ geladene Ionen wie die Chlorid-Ionen heißen Anionen. Das Salz Natriumchlorid besteht also aus Ionen - es ist eine Ionenverbindung.
Die chemische Wertigkeit hilft beim Ermitteln von Verbindungsformeln (Summenformeln)
Die Wertigkeit ist ein Hilfsmittel zur Formelermittlung von Verbindungen. Das folgende Video erklärt, wie es geht. Unter der Video ist noch eine schriftliche Arbeitsanleitung mit einem etwas anderen, aber genauso gut funktionierenden Weg. Wie ihr es macht ist Eure Sache - jeder wie er will.
Wertigkeit ermitteln
Zu ihrer Ermittlung brauchen wir ein Periodensystem der Elemente (PSE), denn die Wertigkeit steht im Zusammenhang mit der Hauptgruppenzugehörigkeit. Hier gibt es ein PERIODENSYSTEM DER ELEMENTE zum ausdrucken.
Wir erhalten durch Anwendung der Wertigkeit die hinter dem jeweiligen Symbol in der Formel kleingeschrieben notierten Indexzahlen.
Die Wertigkeit gibt an,
- wie viele Wasserstoffteilchen das Teilchen eines Elementes in einer Verbindung ersetzen kann (positive Wertigkeit, z.B. Na hat die Wertigkeit +I, Be die Wertigkeit +II, Al die Wertigkeit +III ... Sie entspricht bei den Hauptgruppen I-III der Hauptgruppennummer.
- oder wie viele Wasserstoffteilchen es in einer Verbindung an sich binden könnte (negative Wertigkeit = Abstand zur Hauptgruppe VIII, z.B. Sauerstoff (VI. Hauptgruppe, Wertigkeit: VI-VIII = -II, C ist in der IV. Hauptgruppe, Wertigkeit IV - VIII = -IV).
Bei einer richtigen Formel für eine Verbindung ist die Summe der Wertigkeiten aller beteiligter Teilchen = 0. Siehe auch: Artikel zur Wertigkeit bei Wikipedia.
Beispiele:
1) Formel für Natriumchlorid?
Na ist in der ersten Hauptgruppe ----> Wertigkeit +I
Chlor ist in der siebten Hauptgruppe ----> Abstand zur achten Hauptgruppe => VII - VIII = -I
+I und -I ergibt 0 => wir brauchen jeweils 1 Atom Na und ein Atom Cl: NaCl
2) Formel für Lithiumoxid?
Li ist in der ersten Hauptgruppe ---> Wertigkeit +I
Sauerstoff ist in der sechsten Hauptgruppe ---> Abstand zur achten Hauptgruppe => VI - VIII = -II
Hier wendet man zum Herausfinden der Zahlen das kleinste gemeinsame Vielfache an: I und II haben zwei als kleinstes gemeinsames Vielfaches.
2x +I ergibt +2 und 1x -II ergibt -2. Die Summe daraus ist 0 => wir brauchen jeweils 2x Li und 1x O:

3) Formel für Aluminiumoxid?
Aluminium ist in der dritten Hauptgruppe ---> Wertigkeit +III
Sauerstoff ist in der sechsten Hauptgruppe ---> Abstand zur achten Hauptgruppe => VI - VIII = -II
Hier wendet man zum Herausfinden der Zahlen das kleinste gemeinsame Vielfache an: II und III haben 6 als kleinstes gemeinsames Vielfaches.
Mit 2x +III und 3x -II kommt man auf 0 => wir brauchen jeweils 2x Al
und 3x O:
Al2O3
Hier die Vorgehensweise beim Aluminiumoxid mit Erklärung noch einmal im Video:
Weihnachtsferien 2020/2021
Moleküle: Teilchen, in denen Atome durch Elektronenpaarbindungen / Atombindungen verbunden sind
Achtung: Aus technischen Gründen können hier auf dieser Seite bei Formeln im Text die Zahlen leider nicht korrekt, also klein als Index, geschrieben werden. Die Formel für Wasser wird daher zu H2O statt

Traubenzucker und reines Wasser leiten den elektrischen Strom nicht. Auch eine Zuckerlösung, also in Wasser gelöster Zucker, leitet den elektrischen Strom nicht und unterscheidet sich daher deutlich von Ionenverbindungen / Salzen. Zucker und Wasser bestehen offenbar nicht aus Ionen. Was hält dann die 24 Atome im Zucker- und die drei Atome im Wasserteilchen zusammen?
Es sind so genannte Elektronenpaarbindungen. Bei ihrer Bildung steuern beide Bindungspartner jeweils ein zuvor ungepaartes Elektron zu einem gemeinsamen bindenden Elektronenpaar bei.
Die durch Elektronenpaarbindungen (auch Atombindungen genannt) zusammen gehaltenen Teilchen einer Verbindung nennt man Moleküle. Durch die Bildung der gemeinsamen Elektronenpaare erreichen beide Bindungspartner die energetisch vorteilhafte Edelgaskonfiguration ihrer Elektronenhülle.
Man kann mit der Lewisschreibweise und wenigen Regeln mittels Atomsymbolen und Streichhölzern Moleküle "basteln". So geht´s:
Elektronenpaare mit ihren zwei Elektronen werden durch Streichhölzer dargestellt. Ein halbes Streichholz entspräche einem Elektron.
Regel 1: Alle Atome müssen eigene Valenzelektronen entsprechend ihrer Stellung im Periodensystem haben. 1. Hauptgruppe = 1 Außenelektron, 2. Hauptgruppe 2 Außenelektronen ....
Regel 2: Alle Atome im Molekül erreichen die Edelgaskonfiguration (Oktettregel), d.h. sie kommem mit ihren eigenen und den Bindungselektronen auf 8 oder wie Helium auf 2 Außenelektronen in der äußersten bzw. ersten Elektronenschale. Hierbei werden die beiden Elektronen von Elektronenpaarbindungen jeweils bei beiden Bindungspartnern mitgezählt.
Regel 3: Die Gesamtzahl der Elektronen im Molekül entspricht der Summe der Elektronen aller Atome des Moleküls.
Dies bedeutet z.B. beim Wassermolekül H2O, dass insgesamt maximal 6 (vom O) + 2x 1 (von den zwei H) = 8 Außenelektronen zur Verfügung stehen.
Lewisschreibweise und Valenzstrichformeln
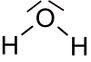
Und wie man sieht, werden in der Strukturformel tatsächlich insgesamt vier Striche verwendet. Da jeder Strich gleichbedeutend mit 2 Elektronen ist, kommt man auf insgesamt 8 Außenelektronen im Wassermolekül. Alle Atome erreichen Edelgaskonfiguration. Sauerstoff hat insgesamt 8 Außenelektronen zur Verfügung (6 eigene plus zwei zusätzliche aus den zwei Bindungen zum Wasserstoff), Wasserstoff hat insgesamt zwei Außenelektronen auf der innersten Schale zur Verfügung und erreicht damit die Edelgaskonfiguration vom Heliumatom (je ein eigenes und eins aus der Bindung zum Sauerstoff).
Ungewöhnliche Eigenschaften von Wasser und ihr chemischer Hintergrund
Zwischen Atomen mit gleichartiger Elektronegativität sind die bindenden Elektronenpaare gleich verteilt, z.B. im Wasserstoff H2, im Sauerstoff O2 etc.... Es liegt eine unpolare Atombindung vor. Bei ungleichen Bindungspartnern wird das bindende Elektronenpaar durch den elektronegativeren Bindungspartner stärker angezogen und etwas in seine Richtung gerückt. Es liegt ein polare Atombindung vor. Im Molekül hat der elektronegativere Partner eine partiell negative Teilladung und der schwächere Partner eine partiell positive Teilladung. Bei gewinkelten Molekülen wie dem Wasserteilchen entsteht dadurch ein Dipol, da in ihnen die Ladungsschwerpunkte nicht übereinander liegen. Dies ist die Grundlage der erstaunlichen Eigenschaften von Wasser, siehe Buch S. 204-205 und 208 (Praktikum).
Videos hierzu:
Wasserstoffbrückenbindungen und polare Elektronenpaarbindungen
Wasser und Wasserstoffbrücken zwischen Wassermolekülen
Metallbindung
Eine dritte Art von Bindung zwischen Atomen findet man in den Metallen. Metalle sind im festen und geschmolzenen Zustand gute elektrische Leiter. Daher müssen sie frei bewegliche elektrische Ladungsträger (z.B. Elektronen) enthalten. Durch das einander Anlagern der einzelnen ungeladenen Metallatome entstehen im festen Metall offenbar frei bewegliche Ladungsträger.
Man kann sich dies so vorstellen: Die nur locker gebundenen Valenzelektronen auf der äußersten belegten Elektronenschale werden von den Metallatomen in den leeren Raum zwischen den Atomen abgegeben. Sie sind dort frei beweglich und bilden das so genannte Elektronengas, das die verbleibenden positiv geladenen Atomrümpfe (bestehend aus dem Atomkern und allen inneren Elektronenschalen) umgibt und die Abstossungskräft zwischen den Atomrümpfen kompensiert und sie dadurch zusammen hält.
Die Elektronen des Elektronengases sind leicht verschiebbar, so dass Metalle auch als Feststoff den elektrischen Strom gut leiten.
Welche Bindungsart liegt in einer Verbindung vor?
Welche Bindungsart in einer Verbindung vorliegt kann man aufgrund ihrer Eigenschaften erkennen. Leitfähigkeit im festen, flüssigem und gasförmigen Zustand findet man bei Metallen, aber nicht bei Salzen oder Verbindungen mit Elektronenpaarbindungen. Salze sind nur im flüssigen oder gasförmigen Zustand elektrische Leiter. Verbindungen mit Elektronenpaarbindungen sind selten elektrisch leitfähig.
Falls aber die Eigenschaften einer Verbindung nicht bekannt sind kann man sich mit einer Faustregel behelfen:
- Liegt der Unterschied der Elektronegativität der Bindungspartner zwischen 0 und größer / gleich 0,4, so liegt eine unpolare Elektronenpaarbindung / Atombindung vor. Der Stoff gehört zu den unpolaren Molekülverbindungen und ist elektrischer Nichtleiter.
- Liegt der Unterschied der Elektronegativität der Bindungspartner zwischen 0,41 und 1,7, so handelt es sich um eine polare Elektronenpaarbindung / Atombindung.
- Bei einem Unterschied der Elektronegativität der Bindungspartner größer als 1,7 liegt eine Ionenverbindung / salzartige Verbindung mit Ionenbindung vor.
Zusammenfassung:
unpolare Elektronenpaarbindung < = 0,4 polare Elektronenpaarbindung < = 1,7 Ionenbindung
Einfach ätzend: Säuren und Laugen
Leitfähigkeitsexperimente mit Zitronensäure und HCl zeigen, dass erst beim Kontakt von Säure mit Wasser durch eine chemische Reaktionen des Säuremoleküls mit dem Wasser Ionen und eine saure Lösung (pH < 7) entstehen. Die Ionenbildung ist durch das Auftreten von elektrischer Leitfähigkeit erst nach dem Lösen der Säure in Wasser erkennbar (geschmolzene Zitronensäure leitet den elektrischen Strom nicht!).
Das hier gezeigte Experiment funktioniert übrigens genauso gut mit Zitronensaft. Woran könnte dies liegen?

Aus Rotkohl wird beim kochen Blaukraut oder Rotkraut, je nach Rezept.
Bei Zugabe eines Apfels oder irgendwie andersartiger Zufuhr von Säure entsteht aus Rotkohl beim kochen Rotkraut. Beim Kochen in Wasser entsteht dagegen Blaukraut. Der Farbstoff im Rotkohl ändert seine Farbe pH-abhängig. Bei stark alkalischen pH wird er grün!
Der wässrige Saft von gekochten Rotkohl eignet sich als Indikator ("Anzeigemittel") zum Nachweis von Säure und zur pH-Bestimmung. Oben siehst Du eine Reihe mit von links nach rechts steigenden pH-Wert. Auf den Schilderchen stehen die Konzentrationen eines bestimmten typischen Ions in Wasser.
Eine Aufstellung der typischen Eigenschaften von Säuren findet man hier.
Beispiele von Säuren aus unserem Alltag zeigt die folgende Abbildung.

Leitfähigkeitsexperimente mit Zitronensäure und HCl zeigen, dass erst beim Kontakt von Säure mit Wasser durch eine chemische Reaktionen des Säuremoleküls mit dem Wasser Ionen und eine saure Lösung (pH < 7) entstehen. Die Ionenbildung ist durch das Auftreten von elektrischer Leitfähigkeit erst nach dem Lösen der Säure in Wasser erkennbar (geschmolzene Zitronensäure leitet den elektrischen Strom nicht!).
HCl-Springbrunnenversuch-Video mit der R9a (Video-Chat) bei Youtube
Bitte Video ansehen!
HCl-Springbrunnenversuch-Video bei Youtube (Fremdfilm)
Der Springbrunnenversuch mit HCl-Gas zeigt, dass sich HCl-Gas sehr gut in Wasser löst. Ein Indikator im Wasser zeigt zudem, dass hierbei durch eine chemische Reaktion eine saure Lösung entstanden ist. Das HCl-Molekül zerfällt (der Chemiker sagt hierzu "es dissoziiert") bei der Reaktion mit Wasser in ein positiv geladenes Hydronium-Kation und ein Chlorid-Anion (s.o.).
Die Dissoziation von HCl-Molekülen

Das Hydronium-Kation lässt sich nachweisen, indem man elektrischen Gleichstrom durch eine beliebige saure Lösung leitet. An der negativ geladenen Elektrode, der Kathode, entsteht bei allen sauren Lösungen ein Gas, das sich durch die Knallgasprobe als Wasserstoff identifizieren lässt.
Das Hydronium-Kation ist in allen sauren Lösungen enthalten und exakt dieses Teilchen wird vom pH-Indikator erkannt (detektiert).
Vom Naturwissenschaftler Arrhenius stammt die Säuredefinition, wonach Säuren aus wasserstoffhaltigen Molekülen bestehen, die in Wasser H+-Ionen (Protonen) abspalten. Die H+-Ionen sind ein "nackter" Wasserstoff-Atomkern ohne Elektronen. Sie werden sofort von anderen Teilchen mit mindestens einem freien Elektronenpaar, in der Regel Wassermoleküle, gebunden. Dadurch entstehen die säuretypischen H3O+-Moleküle der sauren Lösungen ( = verdünnte Säuren), oder aber z.B. das H+-Indikatormolekül, das eine andere Farbe hat als das H+-freie, "normale" Indikatormolekül.
Entstehung von Säuren / Sauren Lösungen
Zwei wesentliche Wege zur Herstellung von Säuren gibt es:
1) Säuren entstehen durch die Reaktion von Wasserstoff und Halogen und die Lösung des Halogenwasserstoffes in Wasser.
Beispiel: Wasserstoff und Chlor reagieren in der Chlorknallgasreaktion zu Chlorwasserstoff (HCl). Dieser wird dann gelöst in Wasser (siehe Salzsäurespringbrunnen) und dies ergibt Salzsäure.
Durch Bildung von Halogenwasserstoffen und lösen der Produkte in Wasser lassen sich auch die anderen Halogenwasserstoffsäuren und saure Lösungen dieser Säuren herstellen: Wasserstoff und Fluor ----> Fluorwasserstoff (HF). Dieser reagiert mit Wasser zur verdünnten Flusssäure, Wasserstoff und Brom ----> Bromwasserstoff (HBr). Dieses reagiert mit Wasser zur verdünnten Bromwasserstoffsäure ....
2) Die zweite Möglichkeit zur Herstellung von Säuren kennt Ihr bereits aus dem letzten Schuljahr. Da haben wir uns ein Umweltproblem aus den 90-igern angesehen - Waldsterben durch Sauren Regen.
Wie die unten folgenden Bilder zeigen, reagieren Pflanzen sehr empfindlich auf die Einwirkung der Säure (jeweils rechts im Bild, zur Vergrößerung bitte auf die Bilder klicken). Hier wurde der Schwefel in einer Glasglocke verbrannt, in der sich Gartenkresse (das ist die grüne Pflanze) befindet und dann in der jetzt Schwefeldioxid-haltigen Atmosphäre mit einer Sprühflasche Regen simuliert.
Im Kontrollexperiment (jeweils links) wurde bis auf das Verbrennen des Schwefels alles gleichartig gemacht.
Säuren entstehen also auch durch die Reaktion von Nichtmetalloxiden mit Wasser. Zum Beispiel:
1a) Schwefel (s) + Sauerstoff (g) -----> Schwefeldioxid (g)
S (s) + O2 (g) -----> SO2 (g)
1b) Schwefeldioxid (g) + Wasser (l) -----> Schweflige Säure (l)
SO2 (g) + H2O (l) ------> H2SO3 (l)
2a) Kohlenstoff (s) + Sauerstoff (g) -----> Kohlenstoffdioxid (g)
C (s) + O2 (g) -----> CO2 (g)
2b) Kohlenstoffdioxid (g) + Wasser (l) -----> Kohlensäure (l)
CO2 (g) + H2O (l) ------> H2CO3 (l)
Phosphor und Stickstoff reagieren auf ähnliche Weise zur Phosphorsäure und Salpetersäure.
Säuren bilden sich aus den Halogenwasserstoffen oder Nichtmetalloxiden (Säureanhydriden) bei ihrer Reaktion mit Wasser.

Säurestärke
Nach Bronsted und Lowry sind Säuren Stoffe, die ein H+ (Proton) abgeben können. Sie sind Protonendonatoren (Protonenspender).
Für die Abspaltung als H+ muss das H-Atom über eine polare Atombindung gebunden sein. Über eine unpolare Atombindung gebundene H-Atome lassen sich nicht abspalten! Methan (CH4) enthält vier H-Atome und ist trotzdem keine Säure!
Stoffe, die abhängig vom Reaktionspartner als Protonendonor oder -akzeptor reagieren können, wie z.B. Wasser beim Ammoniak (NH3) bzw. Chlorwasserstoff (HCl), nennt man Ampholyt.
Der pH-Wert - was ist das eigentlich genau?
Der pH-Wert ist der negative dekadische Logarithmus (= „Zehnerlogarithmus“) der Wasserstoffionen-Konzentration:
Man denke daran, dass der log von 10 hoch x = x ist und somit der negative dekadische Logarithmus von 10 hoch -1 folglich gleich 1 ist.
Starke Säuren dissoziieren völlig in H3O+ -Ionen und Säurerestionen. Wenn man die Konzentration einer starken Säure kennt, lässt sich daher der pH-Wert errechnen. Zum Beispiel entstehen in einer 0,01 mol pro L Salzsäure 0,01 mol pro L H3O+ - Ionen. Dies entspricht 10 hoch -2 mol pro L. Der pH-Wert ist folglich 2.
Säuren sind unterschiedlich stark!
Wie sauer eine wässrige Säurelösung ist, ist abhängig von der Stoffmengenkonzentration (angegeben in mol pro Liter) der Säure und ihrem typischen Dissoziationsgrad, d.h. wie häufig die Säuremoleküle dieser Säure in die sauren H3O+-Ionen und die Säurerestionen zerfallen. So zeigt eine 0,1 mol pro Liter konzentrierte Salzsäurelösung den pH-Wert 1, eine gleich stark konzentrierte Essigsäurelösung dagegen aufgrund geringerer Dissoziation (nur ca. 1% der Essigsäuremoleküle zerfallen im Wasser in Ionen) nur den pH-Wert 3. Essigsäure ist also eine schwache, Salzsäure wegen ihrer vollständigen Dissoziation dagegen eine sehr starke Säure.
Es gilt für die Säurestärke: Salzsäure > Schwefelsäure > Salpetersäure >> Phosphorsäure > Essigsäure >> Kohlensäure.
Laugen
Der Ammoniakspringbrunnen: Ammoniakgas reagiert mit Wasser zu einer Lauge
Wir haben im Unterricht gesehen, dass sich Ammoniakgas NH3 (g) sehr gut in Wasser löst. Dabei zeigte uns der dem Wasser zugefügte Indikator, dass im Gegensatz zum HCl-Springbrunnen diesmal eine alkalische Lösung entstanden ist (Experiment im Film anschauen). Die Hydroxidionen können nur durch Protonenübertragung von einem Wassermolekül auf das Ammoniakmolekül entstanden sein.
NH3 + H20 ---> NH4+ + OH-
Auch beim Lösen von NaOH, LiOH, Mg(OH)2 und anderen Hydroxiden in Wasser lässt sich eine Blaufärbung des Indikators Bromthymolblau beobachten. Es ist eine alkalische Lösung, eine Lauge, entstanden. Da alle Metallhydroxide (MeOH) beim auflösen in Wasser alkalische Lösungen entstehen lassen, muss dies auf die Hydroxidgruppe OH- zurückzuführen sein.
Möglichkeiten zur Herstellung alkalischer Lösungen:
1.) Einfachster Weg: Auflösen eines Metallhydroxides in Wasser.
2.) Unedle Metalle und Wasser. Unedle Metalle wie z.B. die Alkalimetalle Li, Na, K .... reagieren mit Wasser zu alkalischen Lösungen und Wasserstoff, siehe Reaktion der Alkalimetalle Li bis Cs mit Wasser (FILM).
3.) Metalloxide lösen sich in Wasser unter Bildung alkalischer Lösungen.
4.) Ammoniakgas in Wasser einleiten.
Basen bestehen nach der erweiterten Säure-Base-Theorie von Bronsted und Lowry aus Molekülen, welche ein Proton (H+) an sich binden können. Sie sind Protonenakzeptoren. Für die Bindung des Protons brauchen sie ein freies Elektronenpaar.
Nach Bronsted und Lowry sind Säuren dagegen Stoffe, die ein H+ (Proton) abgeben können. Sie sind Protonendonatoren (Protonenspender). Für die Abspaltung als H+ muss das H-Atom über eine polare Atombindung gebunden sein. Über eine unpolare Atombindung gebundene H-Atome lassen sich nicht abspalten! Methan (CH4) enthält vier H-Atome und ist trotzdem keine Säure!
Neutralisation
Zusammengeben von Säure und Lauge führt zur Neutralisation. Gibt man zu einer sauren Lösung, z.B. Salzsäure HCl(aq), mit dem Indikator Bromthymolblau langsam eine Lauge, z.B. Natronlauge (Na+(aq) und OH-(aq)), so beobachtet man Erwärmung und einen Farbumschlag von gelb zu grün und mit noch mehr Lauge schließlich zu blau. Diese Beobachtung zeigt, dass H30 + / H+-Ionen verschwinden. Sie reagieren mit den Hydroxidionen (OH-) zu ungeladenen Wassermolekülen. Zurück bleiben die gelösten Restionen der Säure und Lauge, die beim Abdampfen des Wasser Salz, hier Kochsalz NaCl, bilden. Bei der Neutralisation entsteht Wärme, Wasser und ein Salz.
Virtuelle Titration I: https://www.seilnacht.com/Analyse/titrier.htm
Interaktives Titrieren am PC / Handy https://kappenberg.com/akminilabor/apps/titrationstrainer.html#titrationstrainer-game
Aufstellen einer Reaktionsgleichung in Symbolschreibweise
1) Summenformel ermitteln
Die Summenformel gibt die Zusammensetzung einer Verbindung an. Ich benutze lieber den aussagekräftigeren Begriff "Verbindungsformel".
Zuerst muss man feststellen, wie viele Teilchen eines Elementes mit wie vielen Teilchen eines zweiten Elementes in der Verbindung verbunden sind. Hierzu benutzen wir die Wertigkeit. Zu ihrer Ermittlung brauchen wir ein Periodensystem der Elemente (PSE), denn die Wertigkeit steht im Zusammenhang mit der Hauptgruppenzugehörigkeit. Letztendlich erhalten wir durch Anwendung der Wertigkeit die hinter dem jeweiligen Symbol in der Formel kleingeschrieben notierten Indexzahlen. Die Wertigkeit gibt an, wie viele Wasserstoffteilchen das Teilchen eines Elementes in einer Verbindung ersetzen kann (positive Wertigkeit, z.B. Na hat die Wertigkeit +I, Be die Wertigkeit +II, Al die Wertigkeit +III ... oder wie viele Wasserstoffteilchen es in einer Verbindung an sich binden könnte (negative Wertigkeit = Abstand zur Hauptgruppe VIII, z.B. Sauerstoff (VI. Hauptgruppe, Wertigkeit: VI-VIII = -II). Bei einer richtigen Formel für eine Verbindung ist die Summe der Wertigkeiten aller beteiligter Teilchen = 0. Siehe auch: Artikel zur Wertigkeit bei Wikipedia.
2) Koeffizienten ermitteln und einfügen
Nachdem die Verbindungsformel gefunden ist, muss die Anzahl jeder Teilchensorte auf der Eduktseite (links vom Reaktionspfeil) mit der auf der Produktseite (rechts vom Reaktionspfeil) ausgeglichen werden, denn Teilchen und Masse können weder verschwinden, noch aus dem Nichts auftauchen! Dazu verwendet man Koeffizienten (das sind die groß geschriebenen Zahlen vor den Symbolen).
In aller Kürze - so geht´s:
1.) Übersetzen aller Stoffe in Symbolschreibweise
2.) Ermitteln der Verbindungsformel von Produkten (evtl. auch der Ausgangsstoffe / Edukte) mit Hilfe der Wertigkeiten. ---> hier werden die kleinen Zahlen (Indexzahlen) IN DER FORMEL ermittelt.
Immer beachten: Die Elemente H, N, O, F, Cl, Br, I kommen als zweiatomige Moleküle vor, also H2, N2, O2 .... (die zwei sollte hier jeweils klein unten rechts am Symbol stehen - geht hier leider technisch nicht)
3.) Ausgleichen der Reaktionsgleichung - so geht´s (erklärendes Video) -----> Beim Ausgleichen werden die GROßEN Zahlen innerhalb der Reaktionsgleichung VOR den Formeln der Verbindungen oder Elementen ermittelt.
 Naturwissenschaften an der
Kopernikusschule Freigericht
Naturwissenschaften an der
Kopernikusschule Freigericht




